| publiziert
in:
14. Internationale Baustofftagung (14. ibausil) 20.-23. September 2000, Weimar, Bundesrepublik Deutschland, Band 1, S. 1069-1082 (Vortrag) |
B. Wtorov; H.-B. Fischer; J. Stark
Zur Anregung von Naturanhydrit
Einleitung
Materialien auf der Basis von Naturanhydrit finden seit Jahren ihre Anwendung im Bauwesen. Während ihres Verfestigungsprozesses kommt es dabei zu einer geringen Volumenzunahme. Dies ist für die Herstellung vor allem größerer Estrichflächen eine wichtige und günstige Eigenschaft /1, 2, 3 /. Auf Grund des geringen Energieaufwandes während des Produktionsprozesses hat der Baustoff Anhydrit auch aus ökologischer Sicht seine Bedeutung /9/.
Im Ergebnis der chemischen Reaktion von Anhydrit und Wasser entsteht Gips (Calciumsulfatdihydrat):
CaSO4 + 2 H2O à CaSO4 × 2 H2O.
Insbesondere die dabei ablaufenden Lösung- und Kristallisationsvorgänge bedingen das Ansteifen und Verfestigen der Ausgangsmischung. Im Gegensatz zum Calciumsulfathalbhydrat (z.B. Baugips) reagiert Anhydrit mit Wasser sehr langsam und setzt sich meist nicht vollständig um. Dies hat seine Ursache in der recht geringen Löslichkeitsdifferenz von Anhydrit und Dihydrat.
Für Anwendungen im Bauwesen muß die Reaktionsgeschwindigkeit daher deutlich erhöht, der Anhydrit �angeregt� werden. Dies ist prinzipiell möglich durch eine feinere Aufmahlung der Anhydritgesteins sowie durch Änderung der Lösungsverhältnisse, beispielsweise infolge Zugabe verschiedener Salze (Anreger) /4, 5, 6/. Da erstere Variante sehr energieaufwendig ist, werden den Anhydritmischungen zur Fliesestrichherstellung verschiedene Salze beigegeben.
Es lassen sich folgende Arten der Anregung unterscheiden /1,7/:
Aber auch einige Chloride, Fluoride, Carbonate, Phosphate und Nitrate eignen sich zur Anregung von Anhydrit /8/.
Die Anreger beeinflussen in unterschiedlicher Art und Weise wichtige Eigenschaften des Anhydritestrichs: Verarbeitungszeit, Festigkeit, Hydratationsgrad, Volumenstabilität. So beschreibt GRIMME /7/, daß sulfatische Anreger festigkeitserhöhend wirken, basische hingegen die Volumenstabilität fördern.
Ungeachtet zahlreicher und langjähriger Erfahrungen auf dem Gebiet der Naturanhydritestrichanwendung gibt es in der Literatur nur sehr wenige Angaben zu den Auswirkungen einzelner Anreger sowie deren Kombinationen auf wichtige Eigenschaften.
Zielstellung dieser Arbeit war es daher, ausgehend von einer gemischten Anregung (Ca(OH)2 plus K2SO4), die Einflüsse verschiedener weiterer Sulfate auf Anwendungseigenschaften eines Naturanhydritestrichs aufzuzeigen.
Materialien und Untersuchungsmethoden
Als Ausgangsstoff diente ein fein gemahlener Naturanhydrit aus Krölpa. Die gemischte Anregung wurde mittels Weißkalkhydrat und Kaliumsulfat realisiert. Die so erhaltene Grundmischung wurde durch die Zugabe verschiedener Salze in verschiedenen Konzentrationen modifiziert:
KAl(SO4)2 × 12 H2O (Alaun), Na2SO4, (NH4)2SO4, CuSO4, FeSO4 × 7 H2O, MgSO4 × 7 H2O, ZnSO4 × H2O, NaHSO4× H2O und KHSO4.
Das Weißkalkhydrat wurde mit dem Anhydrit gemischt, die Sulfate im Anmachwasser gelöst.
Die Versteifungszeiten wurden mit dem VICAT-Gerät nach DIN 1168 ermittelt.
An Prüfkörpern mit den Abmessungen 40 mm x 40 mm x 160 mm wurden die Druck- und Biegezugfestigkeit nach einer Verfestigungsdauer von 3, 7 und 28 Tagen entsprechend der DIN EN 196-1 bestimmt. Nach eintägiger Lagerung im Feuchtluftkasten und dem Ausschalen erfolgte die Lagerung bei 20 °C und 65 % r.F. bis zum Prüftermin. Vor dem Prüfen wurden die Probekörper bei 45 °C bis zur Massekonstanz getrocknet.
Zur Ermittlung des Hydratationsgrad (HG) wurde die Hydratationsreaktion durch Erwärmung (der zuvor bei 45 °C getrockneten Prüfkörper) auf 350 °C abgestoppt. Der Hydratationsgrad wurde nach folgender Gleichung ermittelt:
mWasser (t)
HG =
MWasser(max)
mWasser (t) - Masse des gebundenen Wassers zum Zeitpunkt t
mWasser (max) - Masse des Wassers, die maximal gebunden werden kann (hier t = 28 d)
Die Volumenstabilität wurde durch Längenänderungsmessungen mit einer modifizierten Schwindrinne charakterisiert.
Ergänzend wurden ausgewählte Zusammensetzungen mittels Röntgendiffraktometrie, DTA, Quecksilberporosimetrie und Elektronenmikroskopie untersucht sowie der pH-Wert bestimmt.
Untersuchungsergebnisse
In Voruntersuchungen wurde ein Wasser-Bindemittel-Wert von 0,38 für den angewandten Anhydrit als geeignet ermittelt. Dieser wurde, unabhängig von der Wirkung der einzelnen Sulfate auf die Verarbeitbarkeit, durchgängig beibehalten.
Festlegung der Grundmischung
Zunächst wurde der Einfluß unterschiedlicher Verhältnisse von Weißkalkhydrat und Kaliumsulfat zueinander untersucht. Die entsprechenden Varianten sind der Tabelle 1 zu entnehmen.
Tabelle 1
Versteifungsverhalten und Hydratationsgrad von Anhydritmischungen in Abhängigkeit von den Zugabemengen an Kaliumsulfat und Weißkalkhydrat
|
Zusätze |
Eigenschaften |
|||
|
K2SO4 (Masse - %) |
Ca(OH)2 (Masse - %) |
VB (min) |
VE (min) |
HG nach 28 d |
|
2,5 |
0,1 |
300 |
472 |
0,442 |
|
2,5 |
0,2 |
156 |
255 |
0,456 |
|
2,5 |
0,3 |
117 |
175 |
0,465 |
|
2,5 |
0,5 |
104 |
139 |
0,471 |
|
1,5 |
0,3 |
170 |
250 |
0,454 |
|
2,0 |
0,3 |
140 |
210 |
0,478 |
|
3,0 |
0,3 |
96 |
150 |
0,434 |
VB Versteifungsbeginn
VE Versteifungsende
HG Hydratationsgrad
Der pH-Wert aller dieser Mischungen lag im Bereich 11,5 ... 13,5 und wurde durch die Zugabemenge des Weißkalkhydrats fixiert.
Die höchsten Festigkeiten wurden bei einer Zugabe von 0,2 ... 0,4 % Weißkalkhydrat erzielt. Der Einfluß des Kaliumsulfats war dabei von untergeordneter Bedeutung.
Bei einer Zugabe von 0,3 % Ca(OH)2 und 2 % K2SO4 setzte sich im Laufe von 28 Ta-gen der meiste Anhydrit zu Gips um (Hydratationsgrad 0,48). Bei der angeführten Konzentration an Kaliumsulfat durchläuft der Hydratationsgrad sein Maximum.
Eine Erhöhung des Weißkalkhydrats bewirkt eine Verkürzung der Versteifungszeiten. Diese ist besonders im Bereich geringer und mittlerer Konzentrationen (0,1 ... 0,3 %) gravierend. Kaliumsulfat bewirkt ebenfalls eine Verkürzung der Versteifungszeiten, allerdings ist diese Abhängigkeit linear.
Ausgehend von möglichst hohen Werten an Festigkeit und Hydratationsfortschritt sowie akzeptablen Verarbeitungszeiten wurde die Rezeptur der Grundmischung (gemischte Anregung) wie folgt festgelegt: Weißkalkhydrat 0,3 % und Kaliumsulfat 2 %.
Die Expansion dieser Grundmischung wurde mit 0,14 mm/m nach 48stündiger Hydratation charakterisiert. Der Teil Volumenzunahme, der durch Wärmeausdehnung hervorgerufen wird (Temperaturerhöhung um 1,65 K infolge Hydratation), beträgt dabei ca. 0,04 mm/m und ist somit von untergeordneter Bedeutung.
Wirkung weiterer Sulfate
Im weiteren sollte untersucht werden, in welcher Art und Weise sich wichtige Eigenschaften der Grundmischung ändern, wenn dieser weitere Sulfate beigegeben werden. Bezogen auf die Masse des Anhydrit wurden die Sulfate KAl(SO4)2 × 12 H2O, Na2SO4, (NH4)2SO4, CuSO4, FeSO4 × 7 H2O, MgSO4 × 7 H2O, ZnSO4 × H2O, NaHSO4× H2O und KHSO4 in folgenden Mengen zugegeben: 0,3 %, 1,0 % und 3 %. Das Hydratwasser wurde dabei allerdings herausgerechnet (blieb unberücksichtigt!). Die erhaltenen Ergebnisse sind in Tabelle 2 zusammengefaßt.
Entsprechend der Wirkung auf den pH-Wert der Grundmischung mit 0,3 % Weißkalkhydrat lassen sich die verwendeten Sulfate in 3 Gruppen einteilen:
(pH < 7) KAl(SO4)2 × 12 H2O, CuSO4, FeSO4 × 7 H2O, NaHSO4 × H2O
(pH = 7 ... 10) (NH4)2SO4, ZnSO4× H2O
(pH = 10 ... 14) Na2SO4, MgSO4 × 7 H2O, KHSO4
Der pH-Wert wurde hierbei näherungsweise mittels pH-Papier bestimmt.
Aus dieser Tabelle ist ersichtlich, daß die beste Anregung dann erreicht wird, wenn die Anhydritmischung �sauer� eingestellt ist (pH-Wert: 4 ... 7). Nach /10/ erhöhen sich im sauren Milieu die Löslichkeit und das chemische Potential des Anhydrits, während in basischer Umgebung die Bildung von Kristallisationskeimen befördert wird.
Tabelle 2
Einfluß verschiedener Sulfate auf Eigenschaften der Anhydritgrundmischung (Anhydrit zuzüglich 2 % Kaliumsulfat und 0,3 % Weißkalkhydrat)
|
Sulfatischer Anreger |
Eigenschaften |
||||||||
|
Art |
Menge (%) |
pH |
VB (min) |
VE (min) |
HG nach 3d |
HG nach 28d |
Druck-festig-keit nach 3d (N/mm2) |
Druck-festig-keit nach 28 d (N/mm2) |
Längenän-derungs-verhalten nach 48 h (mm/m) |
|
Grundmischung |
- |
13 |
120 |
180 |
0,41 |
0,48 |
13,0 |
17,9 |
0,14 |
|
KAl(SO4)2 × 12 H2O |
0,3 |
10,5 |
290 |
375 |
0,36 |
0,49 |
9,8 |
18,0 |
0,26 |
|
0,5 |
9 |
274 |
343 |
0,36 |
0,54 |
10,3 |
23,2 |
- 0,08 |
|
|
1,0 |
7 |
35 |
52 |
0,72 |
0,79 |
28,9 |
38,3 |
5,90 |
|
|
Na2SO4 |
0,3 |
13,8 |
67 |
100 |
0,45 |
0,55 |
17,2 |
23,3 |
0,15 |
|
1,0 |
14 |
57 |
82 |
0,47 |
0,63 |
23,0 |
30,0 |
0,21 |
|
|
3,0 |
14 |
49 |
74 |
0.56 |
0,73 |
16,8 |
28,2 |
0,28 |
|
|
(NH4)2SO4 |
0,3 |
12 |
288 |
348 |
0,35 |
0,50 |
8,8 |
20,2 |
0,17 |
|
1,0 |
10 |
300 |
380 |
0,50 |
0,67 |
13,0 |
27,7 |
0,19 |
|
|
3,0 |
9 |
314 |
405 |
0,61 |
0,66 |
9,5 |
21,2 |
0,40 |
|
|
CuSO4 |
0,3 |
12,5 |
200 |
270 |
0,30 |
0,48 |
5,5 |
18,2 |
- 0,05 |
|
1,0 |
9,5 |
39 |
51 |
0,70 |
0,78 |
27,7 |
39,9 |
0,74 |
|
|
3,0 |
4,5 |
88 |
110 |
0,84 |
0,94 |
30,6 |
39,9 |
2,76 |
|
|
FeSO4 × 7 H2O |
0,3 |
12,5 |
362 |
387 |
0,38 |
0,54 |
15,2 |
21,4 |
0,01 |
|
1,0 |
7 |
64 |
114 |
0,63 |
0,70 |
22,7 |
30,5 |
0,04 |
|
|
3,0 |
5 |
84 |
141 |
0,79 |
0,91 |
28,6 |
37,8 |
0,83 |
|
|
MgSO4 × 7 H2O |
0,3 |
10,5 |
320 |
350 |
0,40 |
0,52 |
13,8 |
22,6 |
0,34 |
|
1,0 |
10 |
247 |
300 |
0,43 |
0,56 |
13,3 |
21,3 |
0,25 |
|
|
3,0 |
10 |
270 |
331 |
0,53 |
0,63 |
11,5 |
21,7 |
0,32 |
|
|
ZnSO4 × H2O |
0,3 |
11 |
300 |
320 |
0,32 |
0,45 |
6,0 |
16,7 |
- 0,62 |
|
1,0 |
7,3 |
50 |
60 |
0,68 |
0,75 |
20,0 |
35,4 |
0,94 |
|
|
3,0 |
7 |
50 |
62 |
0,76 |
0,94 |
31,6 |
42,6 |
1,19 |
|
|
NaHSO4 × H2O |
0,3 |
12,5 |
180 |
203 |
0,40 |
0,54 |
12,0 |
22,5 |
0,15 |
|
1,0 |
9 |
60 |
72 |
0,44 |
0,61 |
17,7 |
32,4 |
0,58 |
|
|
3,0 |
6 |
...* |
...* |
0,62 |
0,73 |
17,0 |
21,8 |
0,73 |
|
|
KHSO4 |
0,3 |
12,5 |
183 |
200 |
0,37 |
0,48 |
11,5 |
21,7 |
0,26 |
|
1,0 |
12,5 |
64 |
99 |
0,60 |
0,60 |
6,0 |
16,7 |
- 0,09 |
|
|
3,0 |
12,5 |
...* |
...* |
...* |
...* |
...* |
...* |
0,65 |
|
...* Werte wurden auf Grund von Gasbildungsprozessen nicht ermittelt
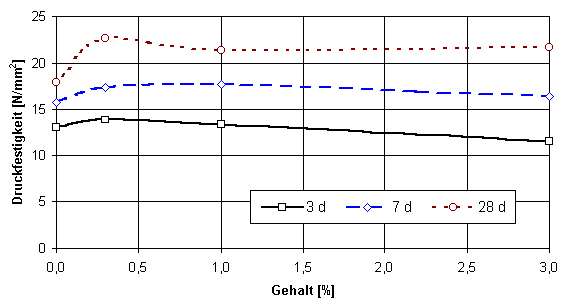
Durch Zugabe der Sulfate lassen sich im Vergleich zur Grundmischung höhere Festig-keiten erzielen. Dabei gibt es Salze mit relativ geringen (Abb. 1) und solche mit ausgeprägtem Einfluß auf die Festigkeitsentwicklung (Abb. 2). Insgesamt läßt sich feststellen, daß bei den meisten Sulfaten bei geringen Zugabemengen (0,3 %) ein Festigkeitsverlust beobachtet werden kann.

Abb. 1
Druckfestigkeit von erhärtetem Naturanhydrit unter Zugabe von MgSO4
× 7 H2O bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)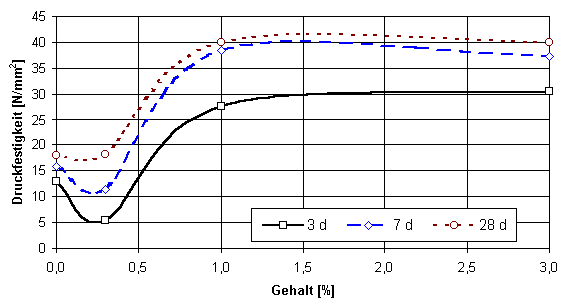
Abb. 2
Druckfestigkeit von erhärtetem Naturanhydrit unter Zugabe von CuSO4 bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)
Wie erwartet verhalten sich dabei Biegezug- und Druckfestigkeit gleichartig (Vergleich Abb. 2 und 3)
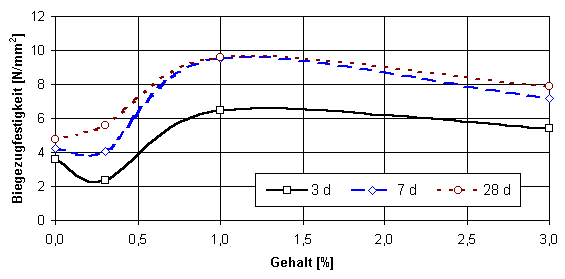
Abb. 3
Biegezugfestigkeit von erhärtetem Naturanhydrit unter Zugabe von CuSO4 bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)
Hinsichtlich der Ursachen für die ermittelten unterschiedlichen Festigkeiten lassen sich in der Literatur verschiedene Auffassungen antreffen. In /11/ wird dem Hydratationsgrad die entscheidende Bedeutung zugeschrieben. Andere Wissenschaftler /12/ sehen im Charakter des Porenraum einen entscheidenden Faktor.
In dieser Arbeit konnte ein enger Zusammenhang zwischen Festigkeitsentwicklung und Hydratationsgrad festgestellt werden (Abb. 4)
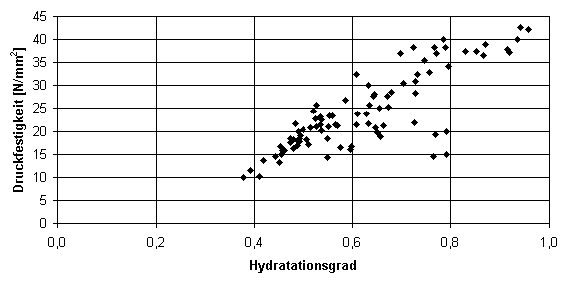
Abb. 4
Zusammenhang zwischen Druckfestigkeit und Hydratationsgrad aller untersuchten Anhydritmischungen
Betrachtet man den Hydratationsfortschritt in Abhängigkeit von der Konzentration des Sulfates (Abb. 5), so erhält man eine der Festigkeit vergleichbaren Darstellung. Wird der Hydratationsgrad über der Hydratationsdauer aufgetragen, so sieht man, daß die chemische Reaktion nach 7 Tagen als (nahezu) abgeschlossen betrachtet werden kann. Innerhalb der ersten 24 Stunden wird dabei über die Hälfte des hydratisierten Anhydrits (50 ... 80 %) umgesetzt (Abb. 6).
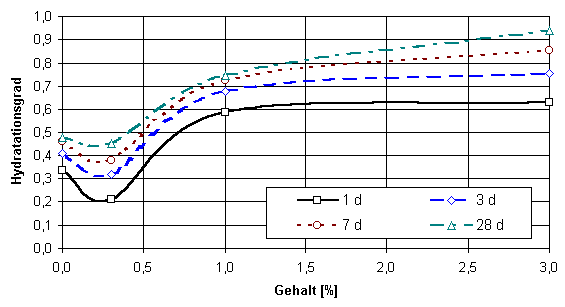
Abb. 5
Einfluß der Zugabemenge an ZnSO4
× H2O auf den Hydratationsgrad von erhärtetem Natur-anhydrit bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)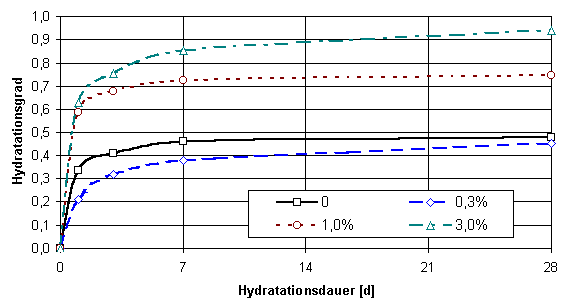
Abb. 6
Hydratationsfortschritt von erhärtetem Naturanhydrit unter Zugabe von ZnSO4
× H2O bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)Der Einfluß der Sulfate auf das Ansteifen der Anhydritmischung ist vergleichbar mit der Wirkung auf den Verfestigungsprozeß. Einige Sulfate (z.B. Kupfersulfat, Eisen- und Magnesiumsulfatheptahydrat) zeigen bei geringen Zugabekonzentrationen ein Extremum (Abb. 7). Bei 0,3 % werden die längsten Verarbeitungszeiten erreicht (entspricht den geringsten Festigkeiten). Abb. 8 hingegen zeigt eine Verzögerung des Ansteifens über den gesamten Konzentrationsbereich.
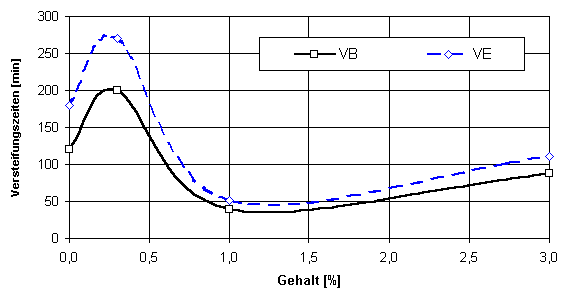
Abb. 7
Versteifungsverhalten von Naturanhydritmischungen unter Zugabe von CuSO4 bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)
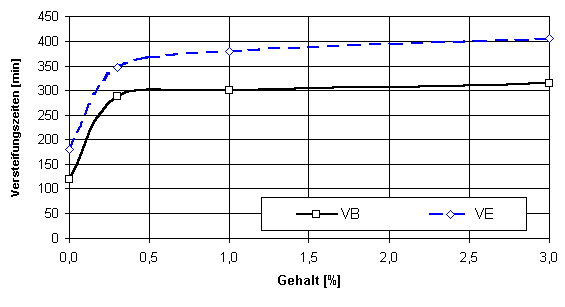
Abb. 8
Versteifungsverhalten von Naturanhydritmischungen unter Zugabe von (NH4)2SO4 bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)
Das Längenänderungsverhalten der Grundmischung weist über den gesamten Untersuchungszeitraum von 48 Stunden eine Volumenzunahme aus. Diese ist allerdings nicht stetig, da zwischen 3. und 10. Stunde ein Teil der ursprünglichen Volumenzu-nahme verlorengeht. Bei einigen Salzen (NaHSO4 × H2O, Na2SO4) verschiebt sich dieser Vorgang hin zu kürzeren, beim MgSO4 × 7 H2O hin zu längeren Verfestigungszeiten (Abb. 9). Die Ursachen hierfür bedürfen noch einer Klärung. Für Kupfersulfat wurde eine deutliche Volumenzunahme bei größeren Zugabemengen gemessen (Abb. 10). Ins-gesamt läßt sich feststellen, daß jedes einzelne Sulfat (teilweise auch abhängig von der Zugabemenge) sehr differenziert das Längenänderungsverhalten beeinflußt. Die größten Volumenzunahmen wurden an solchen Mischungen gefunden, deren pH-Werte im Bereich 4,5 ... 7 lagen und deren Festigkeiten (und damit deren Hydratationsfortschritt) am größten waren.
 Abb. 9
Abb. 9
Längenänderungsverhalten von Naturanhydritmischungen unter Zugabe von MgSO4
× 7 H2O bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)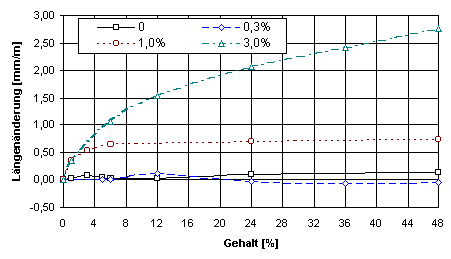
Abb. 10
Längenänderungsverhalten von Naturanhydritmischungen unter Zugabe von CuSO4 bei konstantem Zusatz an Kaliumsulfat (2 %) und Weißkalkhydrat (0,3 %)
Überprüfung der Rezeptur der Grundmischung
Abschließend wurde untersucht, ob eine Verbesserung der Eigenschaften möglich wird, wenn bei konstanter Sulfatkonzentration von 1 % die Zusammensetzung der Grundmischung variiert, d.h. die Konzentrationen an K2SO4 sowie Ca(OH)2 verändert wird. Die Ergebnisse in Tabelle 3 zeigen, daß 2 % Kaliumsulfat in den meisten Fällen eine geeignete Zusatzmenge ist. Eine Erhöhung des Weißkalkhydratanteiles über 0,3 % verhindert bei verschiedenen Sulfaten die Einstellung eines sauren Milieus und führt daher zu Festigkeitsverlusten.
Tabelle 3
Einfluß einer veränderten Rezeptur der Grundmischung auf ausgewählte Eigenschaften
|
Grundmischung |
Sulfatischer Anreger |
Eigenschaften |
|||||
|
K2SO4 (%) |
Ca(OH)2 (%) |
Art |
Menge (%) |
HG nach 3 Tagen |
HG nach 28 Tagen |
Druck- festig- keit nach 3 Tagen (N/mm2) |
Druck- festig keit nach 28 d (N/mm2) |
|
4 |
0,3 |
KAl(SO4)2 × 12 H2O |
1 |
0,71 |
0,79 |
12,0 |
15,0 |
|
2 |
0,3 |
KAl(SO4)2 × 12 H2O |
1 |
0,72 |
0,79 |
28,9 |
38,3 |
|
1 |
0,3 |
KAl(SO4)2 × 12 H2O |
1 |
0,72 |
0,79 |
16,7 |
19,9 |
|
2 |
0,6 |
KAl(SO4)2 × 12 H2O |
1 |
0,35 |
0,54 |
9,1 |
20,1 |
|
4 |
0,3 |
NaSO4 |
1 |
0,49 |
0,65 |
11,0 |
20,8 |
|
2 |
0,3 |
NaSO4 |
1 |
0,56 |
0,73 |
16,8 |
28,2 |
|
1 |
0,3 |
NaSO4 |
1 |
0,48 |
0,65 |
18,4 |
25,0 |
|
4 |
0,3 |
(NH4)2SO4 |
1 |
0,43 |
0,64 |
10,9 |
27,6 |
|
2 |
0,3 |
(NH4)2SO4 |
1 |
0,61 |
0,66 |
9,5 |
27,7 |
|
1 |
0,3 |
(NH4)2SO4 |
1 |
0,45 |
0,64 |
10,9 |
28,2 |
|
2 |
0,6 |
CuSO4 |
1 |
0,30 |
0,46 |
5,1 |
15,7 |
|
2 |
0,3 |
CuSO4 |
1 |
0,84 |
0,94 |
30,6 |
39,9 |
|
1 |
0,3 |
CuSO4 |
1 |
0,69 |
0,72 |
34,0 |
38,2 |
|
2 |
0,6 |
FeSO4 × 7 H2O |
1 |
0,50 |
0,63 |
14,6 |
23,8 |
|
2 |
0,3 |
FeSO4 × 7 H2O |
1 |
0,79 |
0,91 |
28,6 |
37,8 |
|
1 |
0,3 |
FeSO4 × 7 H2O |
1 |
0,68 |
0,76 |
30,1 |
32,8 |
|
2 |
0,3 |
MgSO4 × 7 H2O |
1 |
0,53 |
0,63 |
11,5 |
21,7 |
|
1 |
0,3 |
MgSO4 × 7 H2O |
1 |
0,43 |
0,53 |
14,0 |
20,9 |
|
2 |
0,6 |
ZnSO4 |
3 |
0,77 |
0,96 |
36,2 |
42,3 |
|
2 |
0,6 |
ZnSO4 |
1 |
0,35 |
0,49 |
8,8 |
19,0 |
|
2 |
0,3 |
ZnSO4 |
1 |
0,76 |
0,94 |
31,6 |
42,6 |
|
1 |
0,3 |
ZnSO4 |
1 |
0,72 |
0,83 |
29,1 |
37,5 |
|
2 |
0,6 |
NaHSO4 × H2O |
1 |
0,43 |
0,59 |
14,7 |
26,9 |
|
2 |
0,3 |
NaHSO4 × H2O |
1 |
0,62 |
0,73 |
17,0 |
21,8 |
|
1 |
0,3 |
NaHSO4 × H2O |
1 |
0,61 |
0,68 |
22,7 |
28,5 |
|
1 |
0,3 |
KHSO4 |
1 |
0,48 |
0,55 |
14,0 |
21,0 |
Weitere Untersuchungen
Mittels DTA und Röntgendiffraktometrie konnten die durch Glühverlust ermittelten Resultate des Hydratationsfortschritts an ausgewählten Beispielen bestätigt werden. Besonderheiten wurden nicht beobachtet.
Im Ergebnis der Untersuchungen mittels Quecksilberporosimetrie wurde festgestellt, daß sich einige Proben voneinander unterscheiden. So ergaben sich zwischen der Grundmischung und der Probe Grundmischung plus 1 % Kupfersulfat hinsichtlich Porosität folgende Differenzen: 38,9 % zu 33,0 %. Dabei kam es zu einer Verringerung des mittleren Porenradius von 1,55 auf 1,15 m m.
Die Untersuchungen mittels Elektronenmikroskopie zeigten keine gravierenden Unterschiede zwischen verschiedenen Zusammensetzungen mit guter Festigkeitsentwicklung (15 ... 40 N/mm2). Bei den angewandten Konzentrationen zeigten Dihydratkristalle eine ähnliche Ausbildung. Eine typische Darstellung der Mikrostruktur zeigt Abbildung 11.

Abb. 11
Mikrostruktur der Grundmischung (Naturanhydrit plus 2 % Kaliumsulfat und 0,3 % Weißkalk-hydrat) nach 28tägiger Verfestigung (a � Übersichtsaufnahme, b � Detaildarstellung)
Zusammenfassung
Zur Anregung von Naturanhydrit werden durch Estrichhersteller verschiedene Anregersysteme verwendet. Da über die Auswirkungen einzelner Zusätze sowie deren Wechselwirkung in der Literatur wenig Hinweise zu finden sind, sollte mit der vorliegenden Arbeit ein erster Schritt in diese Richtung getan werden.
Im Ergebnis der Untersuchungen wurde insbesondere festgestellt, daß
Zusammenfassend läßt sich feststellen, daß die einzelnen Zusätze sehr unterschiedliche Auswirkungen auf verschiedene Verarbeitungs- und Anwendungseigenschaften haben. Kombiniert man mehrere Zusätze, so gestaltet sich deren Wechselwirkung oft kompliziert. Dominierend scheint dabei der Einfluß des pH-Wertes der Mischung. Durch die Auswahl bestimmter Zusätze in geeigneten Konzentrationsbereichen lassen sich die angestrebten Kennwerte erreichen.
Literatur